개량신약 임상계획 식약처 승인 획득…5년래 최다
이달에만 당뇨 개량신약 2건 잇따라 품목허가 받아
도입상품 비중 절반 육박…“자체의약품 비중 확대”

▲종근당 본사 전경
종근당이 올해 1분기 국내 제약사 중 가장 많은 임상시험계획 승인을 획득한데 이어 이달 들어서만 개량신약 2건을 품목허가받는 등 자체개발 의약품 확대에 속도를 내고 있다.
17일 의약품 통합정보 시스템 '의약품안전나라'에 따르면 종근당은 올해 1~3월 총 8건의 신약 및 복제약(제네릭) 임상시험 계획을 식품의약품안전처로부터 승인받았다.
이는 한국MSD(10건)에 이어 서울아산병원(8건)과 함께 공동 2위이자 국내 제약바이오기업 중 가장 많은 승인 건수이다.
또한 1분기 8건은 전년동기 3건에 비해 2배 이상 늘었을 뿐 아니라 최근 5년(2021~2025년) 1분기 중 가장 많은 승인 건수이다.
특히 의정갈등 여파로 올해 1분기 국내 전체 임상시험 승인 건수(210건)가 전년동기대비 25% 감소한 것을 감안하면 괄목할 증가세다.
여기에는 암세포의 면역회피 메커니즘을 차단해 면역효과를 높이는 차세대 면역항암신약 'CKD-512' 임상 1상 1건을 비롯해 면역억제제등 제네릭 임상시험(생물학적동등성시험) 7건이 포함됐다.
현재 종근당은 임상 1상 이상을 진행 중인 파이프라인만 20개에 육박하고 이 중 임상 3상 단계인 것만 10개 가까이 돼 자체개발 의약품의 상용화 품목 확대가 기대된다.
이 중 임상 3상을 완료한 개량신약 2개는 이달 들어 연달아 식약처로부터 품목허가를 받았다.
지난 7일 당뇨병 2제 복합제 '엠파맥스에스정'(성분명 엠파글리플로진+시타글립틴)을 품목허가 받은데 이어 16일 당뇨병 3제 복합제 '엠시폴민서방정'(엠파글리플로진+시타글립틴+메트포르민)을 허가받았다.
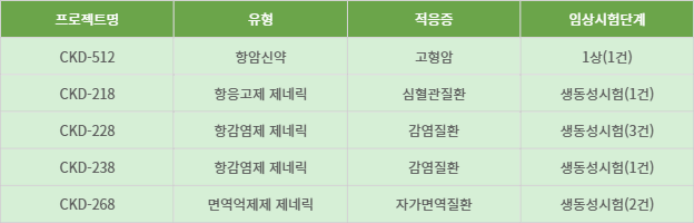
종근당 2025년 1분기 임상시험 승인 현황
▲자료=식품의약품안전처 의약품통합정보시스템 '의약품안전나라'
종근당은 엠파맥스와 엠시폴민에 공통적으로 들어가는 성분인 엠파글리플로진과 시타글립틴이 모두 오는 10월 물질특허가 만료될 예정인 만큼 엠파맥스와 엠시폴민 모두 오는 11월 국내 출시할 계획이다.
특히 미국 머크가 개발한 시타글립틴(제품명 자누비아)은 종근당이 국내 판권을 보유하고 있는 약물로, 연매출 800억원대의 효자 품목이다.
전체 품목 중 매출 비중 4위(지난해 매출 비중 5.1%) 품목인 도입 상품을 자체 제품으로 개발해 수익성을 높임은 물론 자체개발한 국산 20호 신약 '듀비에'와 함께 당뇨 치료제 파이프라인의 시너지를 높일 수 있는 셈이다.
이밖에 현재 임상 3상을 진행 중인 당뇨 치료제 'CKD-383', 탈모 치료제 'CKD-398' 등도 가까운 시일 내에 상용화가 가능할 것으로 기대된다. 지난 2023년 노바티스에 1조7000억원에 기술수출한 희귀질환 치료제 신약후보물질 'CKD-510'도 올해 하반기 노바티스가 향후 개발 계획을 발표할 것으로 전망된다.
종근당은 지난해 매출(1조5864억원)은 전년대비 5% 줄고 영업이익(995억원)은 59.7%나 줄었지만 R&D 투자(1574억원)는 전년대비 4.0% 늘리는 등 실적둔화 속에서도 신약개발 투자를 지속해 왔다.
업계는 종근당 전체 매출 중 외부 도입 상품 비중이 절반에 가까운 47%나 돼 수익성을 높이는데 한계가 있지만 최근 수년간 개량신약 등 R&D 투자에 매년 매출의 9~12%씩 지출해 온 만큼 올해부터 R&D 성과가 가시화될 것으로 전망하고 있다.

